+ Với F, Cl, Br phản ứng đưa sắt kẽm kim loại lên số oxi hóa cao, còn cùng với I phản ứng đưa sắt kẽm kim loại lên số oxi hóa thấp hơn.
Bạn đang xem: Các dạng bài tập về halogen
Bảo toàn electron:
PS : Các việc xây dựng dựa trên nhiều phản ứng lão hóa khử, ta tránh việc giải theo phương pháp truyền thống mà đề nghị ưu tiên phương thức bảo toàn electron.
► các ví dụ minh họa ◄
(Đề thi test THPT giang sơn lần 1 – Sở GD cùng ĐT Quảng Nam, năm 2016)
(Đề thi demo THPT giang sơn lần 2 – thpt Ngô Sĩ Liên – Bắc Giang, năm 2016)
+ Sau phản ứng, một ion halogen này bị sửa chữa bởi một ion halogen khác. đề nghị ta có thể sử dụng phương pháp tăng giảm trọng lượng để giải quyết và xử lý bài toán.
► các ví dụ minh họa ◄
| Ví dụ 4: Sục khí clo dư vào dung dịch chứa muối Na Br và KBr thu được muối hạt Na Cl cùng KCl, bên cạnh đó thấy cân nặng muối giảm 4,45 gam. Thể tích khí clo sẽ tham gia phản ứng cùng với 2 muối bột trên (đo ngơi nghỉ đktc) là A. 4,48 lít. B. 3,36 lít. C. 2,24 lít. D. 1,12 lít. (Đề thi thử THPT non sông lần 2 – trung học phổ thông Chuyên Hạ Long, năm 2016) |
| Ví dụ 5: Hỗn đúng theo X bao gồm Na Br với Na I. Cho hỗn hợp X tung trong nước thu được dung dịch A. Nếu đến brom dư vào hỗn hợp A, sau bội nghịch ứng trả toàn, cô cạn thấy trọng lượng muối khan thu được giảm 7,05 gam. Nếu như sục khí clo dư vào dung dịch A, phản nghịch ứng hoàn toàn, cô cạn dung dịch thấy khối lượng muối khan giảm 22,625 gam. Nhân tố % khối lượng của một hóa học trong tất cả hổn hợp X là: A. 64,3%. B. 39,1%. C. 47,8%. D. 35,9% |
Dạng 3: việc về bội nghịch ứng thoái hóa khử của axit HCl
HCl tác dụng với kim loạiPhương pháp giải+ Phương trình bội phản ứng tổng quát:
M + HCl MCln + H2
Trong đó: M là sắt kẽm kim loại đứng trước H trong dãy chuyển động hóa học.
n là hóa trị thấp duy nhất của kim loại M.
+ Dãy hoạt động hóa học:
K mãng cầu Ca tía Mg Al Zn fe Ni Sb Pb H Cu Hg Ag Pt Au
+ vận dụng định cơ chế bảo toàn electron, định chế độ bảo toàn trọng lượng để giải bài xích toán:► các ví dụ minh họa ◄
| Ví dụ 6: Hòa tan hoàn toàn 8,4 gam fe vào dung dịch HCl dư, thu được dung dịch X và khí Y. Cô cạn dung dịch X chiếm được m gam muối khan. Giá trị của m là A. 24,375. B. 19,05. C. 12,70. D. 16,25. (Đề thi test THPT quốc gia lần 1 – thpt Diễn Châu 2, năm 2016) |
| Ví dụ 7: Hòa tan trọn vẹn 7,8 gam hỗn hợp X bao gồm Al cùng Mg trong hỗn hợp HCl dư nhận được 8,96 lít khí H2 (đktc) cùng dung dịch chức m gam muối. Quý giá của m là A. 22,4. B. 28,4. C. 36,2. D. 22,0 (Đề thi test THPT quốc gia lần 1 – trung học phổ thông Chuyên Sư Phạm HN, năm 2016) |
| Ví dụ 8: đến hỗn hợp bao gồm 5,4 gam Al với 5,6 gam fe phản ứng hoàn toàn với lượng dư dung dịch HCl thu được V lít H2 (đktc). Quý hiếm của V là A. 6,72. B. 10,08. C. 8,96. D. 11,2. (Đề thi demo THPT giang sơn lần 1 – Sở GD và ĐT phái nam Định, năm 2016) |
| Ví dụ 9: mang lại 15 gam tất cả hổn hợp bột sắt kẽm kim loại Zn cùng Cu vào hỗn hợp HCl dư, sau khi phản ứng xảy ra trọn vẹn thu được 4,48 lít khí H2 và m gam chất rắn ko tan. Quý giá của m là: A. 6,4. B. 8,5. C. 2,2. D. 2,0. (Đề thi thử THPT giang sơn lần 2 – trung học phổ thông Lý Thái Tổ, năm 2016) |
| Ví dụ 10: mang đến 12 gam các thành phần hỗn hợp X tất cả Al với Fe vào 100ml hỗn hợp HCl 2M đến phản ứng trọn vẹn thu được khí H2 với 7,0 gam hóa học rắn chưa tan. Thể tích hỗn hợp HCl 2M buổi tối thiểu nên dung nhằm hòa tan hết 12 gam các thành phần hỗn hợp X là A. 0,225 lít. B. 0,275 lít. C. 0,240 lít. D. 0,200 lít. (Đề thi demo THPT quốc gia lần 1 – Sở GD và ĐT nam Định, năm 2016) |
| Ví dụ 11: Hòa tan hoàn toàn 9,95 gam các thành phần hỗn hợp X tất cả Na, K và ba vào 100 ml hỗn hợp HCl 1M thu được hỗn hợp Y và 2,24 lít khí H2 (đo sống đktc). Cô cạn hỗn hợp Y thu được m gam chất rắn. Quý giá của m là A. 15,2. B. 13,5. C. 17,05. D. 11,65. (Đề thi thử THPT nước nhà lần 2 – thpt Chuyên Hạ Long, năm 2016) |
HCl tính năng với hóa học oxi hóa mạnh
Phương pháp giải
+ phản bội ứng giữa HCl và những chất oxi hóa mạnh dạn như (Mn
O2, KMn
O4, K2Cr2O7,…) là phản nghịch ứng thoái hóa khử, buộc phải ta hoàn toàn có thể áp dụng định công cụ bảo toàn electron để xử lý nhanh gọn bài toán.
+ đề xuất nhớ số oxi hóa của các nguyên tố sắt kẽm kim loại chính (Mn, Cr,…) trước cùng sau phản nghịch ứng để thuận lợi cho bài toán giải toán.
+ Định công cụ bảo toàn electron:
► những ví dụ minh họa ◄
| Ví dụ 12: Hòa tan trọn vẹn 52,2 gam Mn O2 trong hỗn hợp HCl đặc, nóng, dư thì sau bội nghịch ứng thu được bao nhiêu lít khí Cl2 sống đktc? A. 11,2. B. 13,44. C. 8,96. D. 6,72. (Đề thi thử THPT quốc gia lần 1 – thpt Yên Lạc 1, năm 2016) |
| Ví dụ 13: đến 23,7 gam KMn O4 phản ứng hết với dung dịch HCl sệt (dư), nhận được V lít khí Cl2 (đktc). Giá trị của V là A. 6,72. B. 8,40. C. 3,36. D. 5,60. |
Dạng 4: việc về HCl tính năng với bazơ, oxit bazơ, muối
Phương pháp giải
+ Các phản bội ứng của HCl với bazơ, oxit bazơ, muối thực chất là làm phản ứng bàn bạc nên hoàn toàn có thể giải câu hỏi theo phương thức tăng sút khối lượng.
+ Oxit bazơ:
Nhìn vào phương trình phản ứng tổng thể trên ta thấy 2 nguyên tử clo đã thay thế sửa chữa 1 nguyên tử oxi phải ta có:
► những ví dụ minh họa ◄
| Ví dụ 14: Để trung hoà 200 ml dung dịch Na OH 1,5M thì thể tích dung dịch HCl 0,5M nên dùng là bao nhiêu? A. 0,5 lít. B. 0,4 lít. C. 0,3 lít. D. 0,6 lít. |
| Ví dụ 15: mang lại 37,6 gam hỗn hợp gồm Ca O, Cu O với Fe2O3 công dụng vừa đầy đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn hỗn hợp sau bội nghịch ứng thì số gam muối bột khan nhận được là A. 80,2. B. 70,6. C. 49,3 D. 61,0. |
| Ví dụ 16: Hoà chảy m gam lếu láo hợp gồm KHCO3 với Ca CO3 vào lượng dư dung dịch HCl. Sau khoản thời gian các phản bội ứng xảy ra hoàn toàn, thu được 11,2 lít khí CO2 (đktc). Quý hiếm của m là A. 60. B. 40. C. 50. D. 70. (Đề thi test THPT giang sơn lần 3 – trung học phổ thông Lý Thái Tổ, năm 2016) |
| Dạng 5: bội phản ứng chế tác kết tủa của halogenVí dụ 17: đến lượng dư dung dịch Ag NO3 vào dung dịch lếu láo hợp gồm 0,1 mol Na F cùng 0,1 mol Na Cl. Cân nặng kết tủa tạo ra thành là A. 14,35 g. B. 10,8 g. C. 21,6 g. D. 27,05 g. |
| Ví dụ 18: cho 26,6 gam hỗn hợp KCl với Na Cl hòa hợp vào nước để được 500 gam dung dịch. Mang đến dung dịch trên tác dụng vừa đầy đủ với Ag NO3 thì chiếm được 57,4 gam kết tủa. Thành phần xác suất theo cân nặng của KCl và Na Cl trong hỗn hợp đầu là: A. 56% với 44%. B. 60% với 40%. C. 70% với 30%. D. 65% cùng 35%. |
| Ví dụ 19: Hoà tan hoàn toàn 24,4 gam lếu hợp tất cả Fe Cl2 với Na Cl (có tỉ lệ thành phần số mol tương ứng là 1 trong : 2) vào một trong những lượng nước (dư), thu được hỗn hợp X. Mang đến dung dịch Ag NO3 (dư) vào hỗn hợp X, sau thời điểm phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Cực hiếm của m là: A. 68,2. B. 28,7. C. 10,8. D. 57,4. (Đề thi thử THPT non sông lần 1 – thpt Lương Ngọc Quyến, năm 2016) |
Dạng 6: bài xích toán xác minh nguyên tố kim loại, phi kim
| Ví dụ 20: Hoà tan trọn vẹn 8,45 gam một kim loại hoá trị II bởi dung dịch HCl. Cô cạn dung dịch sau phản bội ứng được 17,68 gam muối hạt khan. Sắt kẽm kim loại đã sử dụng là A. Ba. B. Zn. C. Mg. D. Ca. (Đề thi thử non sông lần 2 – siêng Thoại Ngọc Hầu, năm 2016) |
| Ví dụ 21: cho 10,8 gam kim loại M tác dụng hoàn toàn cùng với khí Cl2 dư thu được 53,4 gam muối bột clorua. Sắt kẽm kim loại M là A. Mg. B. Al. C. Fe. D. Zn. (Đề thi demo THPT tổ quốc lần 1 thpt Yên Định, năm 2016) | |
| Ví dụ 22: Hoà tan hoàn toàn 3,80 gam tất cả hổn hợp hai kim loại kiềm thuộc hai chu kì liên tục trong dung dịch HCl dư, chiếm được 2,24 lít khí H2 (đktc). Hai kim loại kiềm kia là A. Li cùng Na. B. Na và K. C. Rb và Cs. D. K với Rb. (Đề thi demo THPT non sông lần 2 – thpt Chuyên Sư Phạm HN, năm 2016) | |
| Ví dụ 23: Cho 7,5 gam tất cả hổn hợp X gồm kim loại M (hóa trị không đổi) với Mg (tỉ lệ mol khớp ứng 2 : 3) tính năng với 3,36 lít Cl2, thu được tất cả hổn hợp rắn Y. Hòa tan hết toàn thể Y vào lượng dư dung dịch HCl, nhận được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo nghỉ ngơi đktc. Sắt kẽm kim loại M là A. Al. B. Na. C. Ca. D. K. (Đề thi thử THPT đất nước lần 1 – thpt Chuyên ĐH Vinh, năm 2015) | |
| Ví dụ 24: mang đến 1,37 gam các thành phần hỗn hợp X có Fe và sắt kẽm kim loại M hoá trị không đổi tính năng với dung dịch HCl dư thấy hóa giải 1,232 lít khí H2 (đktc). Phương diện khác các thành phần hỗn hợp X trên tác dụng vừa đầy đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMn O4 tính năng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là A. Mg. B. Cu. C. Al. D. Zn. (Đề thi test THPT non sông lần 2 – trung học phổ thông Chuyên Sư Phạm HN, năm 2016) | |
| Ví dụ 25: mang đến 31,84 gam tất cả hổn hợp Na X với Na Y (X, Y là 2 yếu tố halogen ở hai chu kì liên tiếp) vào hỗn hợp Ag NO3 dư thì chiếm được 57,34g kết tủa. Cách làm của nhị muối là A. Na C. Na |
Dạng 7: vấn đề về năng suất phản ứng
Phương pháp giải
+ Tính công suất theo chất tham gia:
+ Tính công suất theo sản phẩm:
+ Nếu bài toán gồm các quá trình:
Lưu ý: tính năng suất theo hóa học thiếu. Hoàn toàn có thể tính trực tiếp sống dạng thể tích, khối lượng.
► những ví dụ minh họa ◄
| Ví dụ 26: cho 3 lít Cl2 bội nghịch ứng với 2 lít H2; công suất phản ứng đạt 80%. Phần trăm thể tích Cl2 trong các thành phần hỗn hợp khí sau làm phản ứng là (các thể tích khí được đo sinh sống cùng đk t0, p) A. 28%. B. 64%. C. 60%. D. 8%. |
| Ví dụ 27: trọng lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần nhằm điều chế 9,36 gam muối hạt Na Cl là (biết H = 80%) A. 3,68 gam cùng 2,24 lít. B. 3,68 gam cùng 1,792 lít. C. 4,6 gam và 1,792 lít. D. 4,6 gam và 2,24 lít. |
Dạng 8: câu hỏi tổng hợp
| Ví dụ 28: đến m gam X tất cả Fe, Fe O, Fe3O4, Fe2O3 vào 400 ml dung dịch HCl 2M, sau phản bội ứng nhận được 2,24 lít H2 (ở đktc), dung dịch Y, với 2,8 gam sắt không tan. Giá trị m là A. 27,2. B. 30,0. C. 25,2. D. 22,4. (Đề thi thử THPT giang sơn lần 2 – trung học phổ thông Hàn Thuyên, năm 2016) |
| Ví dụ 29: tất cả hổn hợp X có Zn , Mg cùng Fe. Hòa hợp hết 23,40 gam các thành phần hỗn hợp X vào dung dịch HCl chiếm được 11,20 lít khí (đktc). Để tác dụng với vừa không còn 23,40 gam tất cả hổn hợp X đề nghị 12,32 lít khí Clo (đktc). Trọng lượng của fe trong tất cả hổn hợp là A. 8,4 g. B. 11,2 g. C. 2,8 g. D. 5,6 g. (Đề thi test THPT quốc gia lần 2 – thpt Chuyên KHTN – HN, năm 2016) |
| Ví dụ 30: Đốt 6,16 gam sắt trong 2,24 lít (đktc) các thành phần hỗn hợp khí X tất cả Cl2 và O2, nhận được 12,09 gam tất cả hổn hợp Y chỉ tất cả oxit và muối clorua (không còn khí dư). Phối hợp Y bằng dung dịch HCl (vừa đủ), thu được dung dịch Z. đến Ag NO3 dư vào Z, nhận được m gam kết tủa. Giá trị của m là A. 27,65. B. 37,31. C. 44,87. D. 36,26. (Đề thi thử THPT giang sơn lần 1 – thpt Chuyên Tuyên Quang, năm 2016) |
D. HỆ THỐNG BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Dạng 1: việc về halogen tác dụng với kim loại
Câu 1: Để chuyển 11,2 gam fe thành Fe
Cl3 thì thể tích khí clo (đktc) phải dùng là
(Đề thi thử THPT nước nhà lần 1 – thpt Triệu Sơn, năm 2016)
Câu 2: đến 5,4 gam Al công dụng hết cùng với khí Cl2 (dư), thu được m gam muối. Quý giá của m là
12,5. B. 25,0. C. 19,6. D. 26,7.
(Đề thi test THPT tổ quốc lần 1 – trung học phổ thông Lê Xoay, năm 2016)
Câu 3: Đốt cháy hoàn toàn m gam fe trong khí Cl2 dư, nhận được 6,5 gam muối. Quý hiếm của m là
2,24. B. 2,80. C. 1,12. D. 0,56.(Đề thi thử THPT tổ quốc lần 1 – thpt Lý hay Kiệt, năm 2016)
Câu 4: Đun nóng na với Cl2 thu được 11,7 gam muối. Trọng lượng Na cùng thể tích khí clo (đktc) đang phản ứng là:
4,6gam; 2,24 lít. B. 2,3gam; 2,24 lít.4,6gam; 4,48lít. D. 2,3gam; 4,48 lít.
Câu 5: Đốt cháy hết 13,6g tất cả hổn hợp Mg, sắt trong bình khí clo dư, sau phản ứng thấy thể tích khí clo giảm 8,96 lít. Trọng lượng muối clorua khan nhận được là
65,0 g. B. 38,0 g. C. 50,8 g. D. 42,0 g.
Câu 6: Để cháy trọn vẹn hỗn hòa hợp X gồm 3,84 gam Mg cùng 4,32 gam Al đề xuất 5,824 lít hỗn hợp khí Y (đktc) có O2 cùng Cl2. Tính % thể tích Cl2 trong tất cả hổn hợp Y?
46,15%. B. 56,36%. C. 43,64%. D. 53,85%.Dạng 2: câu hỏi halogen táo tợn đẩy halogen yếu
Câu 7: tổ hợp toàn 13,76 gam các thành phần hỗn hợp X gồm hai muối hạt Na
Cl với Na
Br vào nước chiếm được dung hoàn dịch X. Cho khí clo lội trường đoản cú từ cho tới dư qua hỗn hợp X thu được dung dịch Y. Làm bay hơi hỗn hợp Y cho tới khi thu được 12,87 gam muối bột khan B. Trọng lượng của Na
Cl trong tất cả hổn hợp X là
Câu 8: Hòa tan hoàn toàn x gam lếu láo hợp tất cả Na
I với Na
Br vào nước thu được dung dịch X . Mang đến Br2 dư vào X được hỗn hợp Y. Cô cạn hỗn hợp thu được y gam hóa học rắn khan.Hòa rã y gam hóa học rắn khan đó vào nước thu được dung dịch Z. Mang đến Cl2 dư vào hỗn hợp Z thu được hỗn hợp T. Cô cạn T nhận được z gam chất rắn khan. Biết những phản ứng xảy ra hoàn toàn và 2y = x + z. Phần trăm khối lượng của Na
Br trong hỗn hợp đầu là
5,4%. B. 4,5%. C. 3,7%. D. 7,3%.
(Đề thi demo THPT nước nhà lần 1 – thpt Chuyên Quốc học tập – Huế, năm 2016)
Dạng 3: bài toán về bội nghịch ứng thoái hóa khử của axit HCl
HCl công dụng với kim loạiCâu 9: tổ hợp m gam Fe bởi dung dịch HCl toàn diện thu được hỗn hợp Y. Cô cạn hỗn hợp Y thu được 25,4 gam muối bột khan. Vậy quý giá của m là
16,8 gam. B. 11,2 gam. C. 6,5 gam. D. 5,6 gam.(Đề thi demo THPT giang sơn lần 1 – thpt Hàn Thuyên, năm 2016)
Câu 10: đến m gam hỗn hợp Zn, Fe tác dụng với toàn diện với 73 gam dung dịch HCl
10%. Cô cạn hỗn hợp thu được 13,15 g muối. Quý giá m là
A. 7,05. 5,3. C. 4,3. D. 6,05.
Câu 11: Hòa tan hoàn toàn 20 gam tất cả hổn hợp Mg và Fe bằng dung dịch HCl dư. Sau phản nghịch ứng chiếm được 11,2 lít khí (đktc) và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối bột khan?
55,5 g. B. 91,0 g. C. 90,0 g. D. 71,0 g.(Đề thi demo THPT non sông lần 1 – trung học phổ thông Phụ Dực – Thái Bình, năm 2016)
Câu 12: mang đến 6,05 gam tất cả hổn hợp X gồm Fe và Zn bội phản ứng trọn vẹn với hỗn hợp HCl loãng (dư), nhận được 0,1 mol khí H2. Trọng lượng của fe trong 6,05 gam X là
1,12 g. B. 2,80 g. C. 4,75 g. D. 5,60 g.(Đề thi demo THPT quốc gia lần 1 – Sở GD và ĐT Bắc Giang, năm 2016)
Câu 13: Hoà tan 7,8 gam hỗn hợp bột Al với Mg trong hỗn hợp HCl dư. Sau phản ứng cân nặng dung dịch tạo thêm 7,0 gam so với dung dịch HCl ban đầu. Cân nặng Al cùng Mg trong các thành phần hỗn hợp đầu là
5,8 gam với 3,6 gam. B. 1,2 gam cùng 2,4 gam.5,4 gam và 2,4 gam. D. 2,7 gam và 1,2 gam.
(Đề thi demo THPT nước nhà lần 1 – thpt Quỳnh giữ 1, năm 2016)
Câu 14: mang lại 17,6 gam tất cả hổn hợp X gồm Fe với Cu phản bội ứng với hỗn hợp HCl loãng (dư), cho đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là?
25,4 g. B. 31,8 g. C. 24,7 g. D. 18,3 g.(Đề thi test THPT non sông lần 3 – trung học phổ thông Quỳnh lưu 1, năm 2016)
Câu 15: hòa tan 9,14 gam tất cả hổn hợp Cu, Mg, Al bởi dung dịch HCl trọn vẹn thu được 7,84 lít khí X (đktc); dung dịch Z cùng 2,54 gam hóa học rắn Y. Lọc bỏ chất rắn Y , cô cạn hỗn hợp Z thu được trọng lượng muối khan là
19,025 g. B. 31,45 g. C. 33,99 g. D. 56,3 g.Câu 16: cho 18,6 gam tất cả hổn hợp Fe cùng Zn vào 500 ml hỗn hợp HCl x mol/l. Sau phản ứng hoàn toàn cô cạn được 34,575 gam hóa học rắn. Nếu cho hỗn hợp trên công dụng với 800 ml hỗn hợp HCl x mol/l cô cạn chiếm được 39,9 gam hóa học rắn. Quý giá của x và cân nặng của fe trong tất cả hổn hợp là:
x = 0,9 và 5,6 gam. B. x = 0,9 cùng 8,4 gam.x = 0,45 với 5,6 gam. D. x = 0,45 cùng 8,4 gam.
(Đề thi thử THPT giang sơn lần 1 – trung học phổ thông Phụ Dực, năm 2016)
Câu 17: Hoà tan trọn vẹn 28,4 gam các thành phần hỗn hợp 3 kim loại hoá trị I với II bởi dung dịch HCl thu được dung dịch A cùng V lít khí (đktc). Cô cạn hỗn hợp A nhận được 49,7 gam các thành phần hỗn hợp muối khan. V có giá trị là?
8,96. B. 5,6. C. 6,72. D. 3,36.(Đề thi demo THPT non sông lần 1 – trung học phổ thông Lương ráng Vinh – HN, năm 2016)
HCl công dụng với hóa học oxi hóa mạnhCâu 18: đến lượng dư Mn
O2 vào 25ml hỗn hợp HCl 8M. Thể tích khí Cl2 hiện ra (đktc) là
Câu 19: muốn điều chế được 3,36 lít khí Cl2 (đktc) thì cân nặng K2Cr2O7 về tối thiểu cần lấy nhằm cho tác dụng với hỗn hợp HCl đặc, dư là
13,2 g. B. 13,7 g. C. 14,2 g. D. 14,7 g.
(Đề thi test THPT giang sơn lần 1 – trung học phổ thông Lê Lợi – Thanh Hóa, năm 2016)
Dạng 4: bài toán về HCl công dụng với bazơ, oxit bazơ, muối
Câu 20: Để th-nc 20 ml dung dịch HCl 0,1M yêu cầu 10 ml dung dịch Na
OH mật độ x mol/l. Giá trị của x là
Câu 21: Khi đến 100ml dung dịch KOH 1M vào 100ml hỗn hợp HCl thì bội phản ứng xẩy ra vừa đủ. Mật độ mol của HCl trong dung dịch đã cần sử dụng là
1,0M. B. 0,25M. C. 0,5M. D. 0,75M.(Đề thi test THPT quốc gia lần 1 – thpt Ngô Gia từ bỏ – Vĩnh Phúc, năm 2016)
Câu 22: đề nghị dùng 300 gam hỗn hợp HCl 3,65% nhằm hòa tung vừa không còn x gam Al2O3. Cực hiếm của x là
51. B. 5,1. C. 153. D. 15,3.
Câu 23: Đốt cháy trọn vẹn 5,8 gam hỗn hợp tất cả Zn và Mg trong không gian thu được hỗn hợp oxit X. Tổng hợp hết X trong dung dịch HCl 1M. Thể tích hỗn hợp axit hòa tan hết được X là :
250 ml. B. 500 ml. C. 100 ml. D. 150 ml.(Đề thi thử THPT nước nhà lần 1 – trung học phổ thông Chuyên Quốc học tập – Huế, năm 2016)
Câu 24: Đốt cháy tất cả hổn hợp X có 3 kim loại Mg, Zn, Cu thu được 34,5 gam tất cả hổn hợp rắn Y gồm các oxit kim loại. Để hòa hợp hết các thành phần hỗn hợp Y yêu cầu dùng hoàn toản dung dịch chứa 0,8 mol HCl. Khối lượng hỗn hòa hợp X là
31,3 g. B. 24,9 g. C. 21,7 g. D. 28,1 g.(Đề thi demo THPT đất nước lần 2 – THPT đường nguyễn trãi – Thanh Hóa, năm 2016)
Câu 25: cho 2,7 gam tất cả hổn hợp X bao gồm Al, Fe và Mg phản bội ứng không còn với O2 dư chiếm được 4,14 gam các thành phần hỗn hợp Y có 3 oxit. đến Y bội phản ứng vừa đủ với V lít dung dịch HCl 0,3M. Quý hiếm của V là
0,30. B. 0,15. C. 0,60. D. 0,12.
(Đề thi test THPT non sông lần 2 – trung học phổ thông Chuyên Tuyên Quang, năm 2016)
Câu 26: cho 4,5 g các thành phần hỗn hợp M bao gồm Na, Ca cùng Mg công dụng hết với O2 dư nhận được 6,9 gam tất cả hổn hợp Y gồm những oxit. Cho Y làm phản ứng toàn vẹn với V lít dung dịch HCl 1M. Quý hiếm của V là
0,15. B. 0,12. C. 0,60. D. 0,30.(Đề thi demo THPT nước nhà lần 1 – trung học phổ thông Trực Ninh, năm 2016)
Câu 27: Cho hỗn hợp 2 muối bột Mg
CO3 và Ca
CO3 rã trong hỗn hợp HCl vừa đủ tạo thành 2,24 lít khí (đktc). Số mol của 2 muối cacbonat lúc đầu là
Câu 28: cho 50 gam Ca
CO3 tác dụng vừa đủ với hỗn hợp HCl 20% (d=1,2g/ml). Cân nặng dung dịch HCl đã sử dụng là
152,08 g. B. 55,0 g. C. 180,0 g. D. 182,5 g.
(Đề thi demo THPT đất nước lần 2 – thpt Lý Thái Tổ, năm 2016)
Câu 29: Hòa tan hoàn toàn 20,6 gam lếu hợp tất cả Na2CO3 cùng Ca
CO3 bởi dung dịch HCl dư, nhận được V lít khí CO2 (đktc) và dung dịch cất 22,8 gam hỗn hợp muối. Cực hiếm của V là
(Đề thi thử THPT tổ quốc lần 1 – thpt Trần Phú – Vĩnh Phúc, năm 2016)
Dạng 5: làm phản ứng chế tạo kết tủa của halogen
Câu 30: đến dung dịch Ba
Cl2 tất cả dư tác dụng với dung dịch Ag
NO3 2M nhận được 28,7 gam kết tủa. Thể tích hỗn hợp Ag
NO3 đã sử dụng là
Câu 31: mang đến 200 ml hỗn hợp Ag
NO3 0,4M tác dụng với 300 ml hỗn hợp Fe
Cl2 0,1M. Hoàn thành phản ứng thu được m gam kết tủa. Cực hiếm của m là:
10,045. B. 10,77. C. 8,61. D. 11,85.
Câu 32: Đốt 13,0 gam Zn vào bình chứa 0,15 mol khí Cl2, sau bội nghịch ứng hoàn toàn thu được chất rắn X. đến X vào dung dịch Ag
NO3 dư thì chiếm được lượng kết tủa là?
(Đề thi demo THPT tổ quốc lần 1 – trung học phổ thông Chuyên Bến Tre, năm 2016)
Dạng 6: bài bác toán khẳng định nguyên tố kim loại, phi kim
Câu 33: mang lại 0,3 gam một sắt kẽm kim loại hóa trị II bội nghịch ứng không còn với hỗn hợp HCl dư, thu được 0,28 lít H2 (đktc). Sắt kẽm kim loại đó là?
Ba B. Ca. C. Mg. D. Sr.(Đề thi thử THPT đất nước lần 1 – thpt Chuyên Lam Sơn, năm 2016)
Câu 34: mang lại 26,5 gam M2CO3 công dụng với một lượng dư hỗn hợp HCl. Sau làm phản ứng nhận được 5,6 lít khí (ở đktc). Sắt kẽm kim loại M là
Na. B. K. C. Li. D. Rb.
(Đề thi thử THPT tổ quốc lần 2 – thpt Nam Phù Cừ, năm 2016)
Câu 35: Đốt 3,36 gam sắt kẽm kim loại M vào khí quyển clo thì thu được 9,75 gam muối bột clorua. sắt kẽm kim loại M là
Cu. B. Zn. C. Fe. D. Al.(Đề thi test THPT non sông lần 1 – trung học phổ thông Chuyên Hạ Long, năm 2016)
Câu 36: mang lại 8,8 gam một lếu hợp có hai sắt kẽm kim loại kiềm thổ ở nhì chu kì liên tiếp tác dụng với hỗn hợp HCl dư nhận được 6,72 lít khí H2 (ở đktc). Hai sắt kẽm kim loại đó là
Ca cùng Sr. B. Be cùng Mg. C. Mg cùng Ca. D. Sr và Ba.(Đề thi demo THPT giang sơn lần 1 – trung học phổ thông Thanh oách A, năm 2016)
Câu 37: Hòa tan trọn vẹn 2,45g hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml hỗn hợp HCl 1,25M thu được dung dịch Y chứa những chất tan bao gồm nồng độ mol bằng nhau. Hai sắt kẽm kim loại kiềm thổ đó là
Be cùng Ca. B. Mg với Ca.Be cùng Mg. D. Mg và Sr.(Đề thi thử
THPT non sông lần 1 – thpt Trực Ninh, năm 2016)
Câu 38: hóa học A là muối canxi halogenua. Dung dịch chứa 0,200 gam A tính năng với lượng dư dung dịch bội nghĩa nitrat thì chiếm được 0,376 gam kết tủa tệ bạc halogenua. Bí quyết phân tử của chất A là
A. CaF2. Ca
Cl2. C. Ca
Br2. D. Ca
I2.
Câu 39: mang lại 0,03 mol các thành phần hỗn hợp Na
X cùng Na
Y ( X, Y là nhị halogen thuộc chu kì tiếp đến ) tính năng với lượng dư hỗn hợp Ag
NO3 thu được 4,75 gam kết tủa. Bí quyết hai muối bột trên là:
Br, Na
I. B. Na
F, Na
Cl.Na
Cl, Na
Br. D. Na
F, Na
Cl hoặc Na
Br, Na
I.
Câu 40: Cho dung dịch chứa 24,12 gam hỗn hợp tất cả hai muối Na
X cùng Na
Y (X, Y là hai nguyên tố có trong trường đoản cú nhiên, ở nhì chu kì liên tiếp thuộc team VIIA, số hiệu nguyên tử ZX Y) vào hỗn hợp Ag
NO3 (dư), thu được 34,44 gam kết tủa. Xác suất số mol của Na
X trong lếu hợp ban sơ là
60%. B. 40%. C. 66,67%. D. 50%.
Câu 41: các thành phần hỗn hợp X bao gồm Al và sắt kẽm kim loại M (trong kia số mol M to hơn số mol của Al). Hòa tan trọn vẹn 1,08 gam các thành phần hỗn hợp X bởi 100 ml dung dịch HCl thu được 0,0525 mol khí H2 và dung dịch Y. Mang đến dung dịch Y tính năng với dung dịch Ag
NO3 dư thu được 17,9375 gam hóa học rắn. Biết M có hóa trị II vào muối sản xuất thành, nhấn xét nào dưới đây đúng?
(Đề thi test THPT tổ quốc lần 2 – thpt Chuyên Phan Bội Châu, năm 2016)
Dạng 7: việc về công suất phản ứng
Câu 42: Nung 17,55 gam Na
Cl với H2SO4 đặc, dư thu được từng nào lít khí ở điều kiện tiêu chuẩn (biết năng suất của bội nghịch ứng là H= 90%)?
Câu 43: đến 2 lít (đktc) H2 công dụng với 1,344 lít Cl2 (đktc) rồi hòa tan thành phầm vào nước và để được 40 gam dụng dịch A. Lấy 10 gam A chức năng với hỗn hợp Ag
NO3 dư chiếm được 3,444 gam kết tủa. Tính hiệu suất phản ứng thân H2 cùng Cl2 (giả sử Cl2 cùng H2 ko tan vào nước)?
Câu 44: trọng lượng thuốc tím với HCl cần dùng để làm điều chế 4,48 lít khí clo là (biết H = 80%)
12,64 gam với 23,36 gam. B. 15,8 gam cùng 29,2 gam.12,64 gam và 14,6 gam. C. 15,8 và 18,25 gam.
Dạng 8: việc tổng hợp
Câu 45: Trong tự nhiên và thoải mái Clo tất cả hai đồng vị bền chiếm phần 24,23% tổng cộng nguyên tử ,còn lại là . Nguyên tố % theo khối lượng của vào HCl
O4 là
(Đề thi demo THPT nước nhà lần 1 – trung học phổ thông Kim Liên, năm 2016)
Câu 46: tất cả hổn hợp X có Mg, Mg
O, Ca và Ca
O. Hòa hợp 10,72 gam X vào hỗn hợp HCl đầy đủ thu được 3,248 lít khí (đktc) cùng dung dịch Y. Trong Y có 12,35 gam Mg
Cl2 cùng m gam Ca
Cl2. Quý hiếm m là
(Đề thi demo THPT nước nhà lần 3 – thpt Trung Nghĩa – Phú Thọ, năm 2016)
Câu 47: mang lại 19,02 gam các thành phần hỗn hợp Mg, Ca, Ca
O, Mg
O, Mg
CO3, Ca
CO3 công dụng với hỗn hợp HCl hoàn toản thu được 4,704 lít tất cả hổn hợp khí (đktc) có tỉ khối so với H2 là 12,5 với dung dịch chứa 12,825 gam Mg
Cl2 với m gam Ca
Cl2. Quý giá của m là
18,78. B. 19,425. C. 20,535. D. 19,98.
(Đề thi demo THPT nước nhà lần 2 – trung học phổ thông Chuyên Phan Bội Châu, năm 2016)
Câu 48: cho 20,4 gam hỗn hợp X bao gồm Al , Zn và Fe chức năng với hỗn hợp HCl dư nhận được 10,08 lít H2. Còn mặt khác 0,2 mol tất cả hổn hợp X chức năng vừa đủ với 6,16 lít Cl2. Tính yếu tố % về trọng lượng của Al trong tất cả hổn hợp X ( biết khí thu được đều đo sinh sống đktc)
33,09%. B. 26,47%. C. 19,85%. D. 13,24%.(Đề thi thử THPT đất nước lần 1 – thpt Chuyên Sư Phạm HN, năm 2016)
Câu 49: mang lại m gam các thành phần hỗn hợp X bao gồm Fe, Al, Cr công dụng hết với lượng dư khí Cl2, thu được (m + 31,95) gam muối. Mặt khác, cũng cho m gam X tan hết trong hỗn hợp HCl dư, thu được 7,84 lít khí H2 (đktc). Xác suất số mol của Al trong X là
33,33%. B. 75,00%. C. 25,00%. D. 66,67%.(Đề thi thử THPT non sông lần 1 – Sở GD với ĐT Bắc Giang, năm 2016)
Câu 50: mang đến 53,75 gam hỗn hợp X gồm kim loại Sn, Fe, Al công dụng vừa đủ với 25,20 lít khí Cl2 (đktc). Còn mặt khác khi mang đến 0,40 mol hỗn hợp X tính năng với dung dịch HCl nóng, dư nhận được 9,92 lít khí H2 (đktc). Biết những phản ứng xẩy ra hoàn toàn. Khối lượng của kim loại Al vào 0,40 mol hỗn hợp X là
1,54. B. 4,05. C. 2,31. D. 3,86.Câu 51: Đốt cháy láo hợp có 1,92 gam Mg với 4,48 gam sắt với khí X gồm O2 cùng Cl2 sau phản nghịch ứng chỉ thu được các thành phần hỗn hợp Y gồm những oxit với muối clorua (không còn khí dư). Tổng hợp Y bằng một số lượng vừa đủ 120 ml dung dịch HCl 2M, thu được dung dịch Z. Mang lại Ag
NO3 dư vào dung dịch Z chiếm được 56,69 gam kết tủa. Tính % thể tích clo trong hỗn hợp X?
(Đề thi test THPT tổ quốc lần 3 – thpt Lý Thái Tổ, năm 2016)
Câu 52: Đốt cháy hỗn hợp tất cả 0,02 mol Mg với 0,03 mol fe với các thành phần hỗn hợp khí X gồm clo cùng oxi, sau bội phản ứng chỉ chiếm được 4,77 gam các thành phần hỗn hợp Y gồm những oxit với muối clorua (không còn khí dư). Phối hợp hết Y bằng 150 ml dung dịch HCl 0,2M, thu được dung dịch Z. Mang đến dung dịch Ag
NO3 loãng dư vào hỗn hợp Z thu được 13,995 gam kết tủa. Tỷ lệ thể tích của oxi trong các thành phần hỗn hợp X là
(Đề thi demo THPT nước nhà lần 1 – trung học phổ thông Chuyên Quốc học – Huế, năm 2016)
Phương pháp giải những dạng bài bác tập chương nhóm Halogen
Với phương pháp giải những dạng bài bác tập chương nhóm Halogen Hoá học lớp 10 tổng hợp các dạng bài bác tập, bài xích tập trắc nghiệm có lời giải chi tiết với đầy đủ phương thức giải, lấy ví dụ như minh họa sẽ giúp đỡ học sinh ôn tập, biết phương pháp làm dạng bài xích tập team Halogen từ đó đạt điểm trên cao trong bài xích thi môn Hoá học lớp 10.

Bài tập trắc nghiệm
Bài tập về đặc thù hóa học tập và phương thức điều chế Halogen
A. Bài tập tự luận
Bài 1. do sao clo độ ẩm có tính tẩy trắng còn clo thô thì không?
Hướng dẫn:
Cl + H2 O → HCl + HCl
O ( Axit hipoclorơ)
HCl
O gồm tính tẩy trắng
Bài 2. Viết 3 phương trình phản nghịch ứng chứng tỏ clo bao gồm tính oxi hóa, 2 phương trình phản nghịch ứng chứng minh clo bao gồm tính khử.
Hướng dẫn:
3 phương trình phản nghịch ứng chứng tỏ Clo có tính oxi hóa:
2Na + Cl2 → 2Na
Cl
2Fe + 3Cl2 → 2Fe
Cl3
H2 + Cl2 → 2HCl
2 phương trình phản bội ứng minh chứng Clo gồm tính khử:
Cl + H2 O → HCl+ HCl
O ( Axit hipoclorơ)
Cl2 + 2Na
OH → Na
Cl + Na
Cl
O + H2 O
Bài 3. a) trường đoản cú Mn
O2 , HCl đặc, sắt hãy viết các phương trình làm phản ứng điều chế Cl2 , Fe
Cl2 cùng Fe
Cl3 .
b) Từ muối ăn, nước và những thiết bị nên thiết, hãy viết những phương trình bội phản ứng điều chế Cl2 , HCl và nước Javel .
Hướng dẫn:
a, Mn
O2 + 4HCl → Mn
Cl2 + Cl2 + 2H2 O
Fe + HCl → Fe
Cl2 + H2 ↑
Fe
Cl2 + 2Cl2 → 2Fe
Cl3
b, 2Na
Cl + 2H2 O → H2 + 2Na
OH + Cl2
Cl2 + H2 → 2HCl
Cl2 + Na
OH → Na
Cl + Na
Cl
O + H2
Bài 4. Viết 1 phương trình bội nghịch ứng minh chứng axit HCl gồm tính oxi hóa, 1 phương trình phản bội ứng minh chứng HCl có tính khử.
Hướng dẫn:
HCl có tính oxi hóa
sắt + 2HCl → Fe
Cl2 + H2
HCl có tính khử
Mn
O2 + 4HCl → Mn
Cl2 + Cl2 + 2H2 O
Bài 5. Viết 3 phương trình phản ứng điều chế sắt (III) clorua.
Hướng dẫn:
Fe
Cl2 + 2Cl2 → 2Fe
Cl3
2Fe + 3Cl2 → 2Fe
Cl3
Fe2 O3 + 6HCl → 2Fe
Cl3 + 3H2 O
Bài 6. Viết phương trình bội phản ứng xẩy ra khi mang đến lần lượt những chất trong team A HCl, Cl2 chức năng với lần lượt những chất trong nhóm B Cu, Ag
NO3 , Na
OH, Ca
CO3 .
Hướng dẫn:
Với HCl:
Cu + HCl → không xảy ra
Ag
NO3 + HCl → Ag
Cl↓ + H2 O
Na
OH + HCl → Na
Cl + H2 O
Ca
CO3 + 2HCl → Ca
Cl2 + CO2 ↑ + H2 O
Với Cl2
Cu + Cl2 → Cu
Cl2
Ag
NO3 + Cl2 → ko xảy ra
2Na
OH + Cl2 → Na
Cl + Na
Cl
O + H2 O
Ca
CO3 + Cl2 → không xảy ra
Bài 7. Axit HCl có thể tác dụng những chất nào sau đây? Viết phản bội ứng xảy ra: Al, Mg(OH) 2 , Na2 SO4 , Fe
S, Fe2 O3 , Ag2 SO4 , K2 O, Ca
CO3 , Mg(NO3 ) 2 .
Hướng dẫn:
2Al + 6HCl → 2Al
Cl3 + 3H2
Mg(OH) 2 + HCl → Mg
Cl2 + H2 O
Na2 SO4 + HCl → ko xảy ra
Fe
S + 2HCl → Fe
Cl2 + H2S↑
Fe2 O3 + 6HCl → 2Fe
Cl3 + 3H2 O
Ag2 SO4 + HCl → Ag
Cl↓ + H2 SO4
K2 O + HCl → KCl + H2 O
Ca
CO3 + 2HCl → Ca
Cl2 + CO2 ↑ + H2 O
Mg(NO3 ) 2 + HCl → ko xảy ra
Bài 9: mang đến dãy các chất sau, hóa học nào có khả năng chức năng được với axit HCl? Viết phương trình chất hóa học của bội nghịch ứng xảy ra, ghi rõ điều kiện của làm phản ứng: Fe, Fe
Cl2 , Fe
O, Fe2 O3 , Fe3 O4 , KMn
O4 , Cu, Ag
NO3 , H2 SO4 , Mg(OH) 2 .
Hướng dẫn:
Các chất có thể công dụng với axit HCl là: Fe, Fe
O, Fe2 O3 , Fe3 O4 , KMn
O4 , Ag
NO3 , Mg(OH) 2 .
PTHH:
Fe + 2HCl → Fe
Cl2 + H2
Fe
O + 2HCl → Fe
Cl2 + H2 O
Fe2 O3 + 6HCl → 2Fe
Cl3 + 3H2 O
Fe3 O4 + 8HCl → Fe
Cl2 +2Fe
Cl3 + 4H2 O
2KMn
O4 + 16HCl → 2KCl + 2Mn
Cl2 + 5Cl2 + 8H2 O
Ag
NO3 + HCl → Ag
Cl + HNO3
Bài 10: trong những hình vẽ tế bào tả biện pháp thu khí clo sau đây, hình mẫu vẽ nào mô tả đúng chuẩn thu khí clo trong chống thí nghiệm? Giải thích?
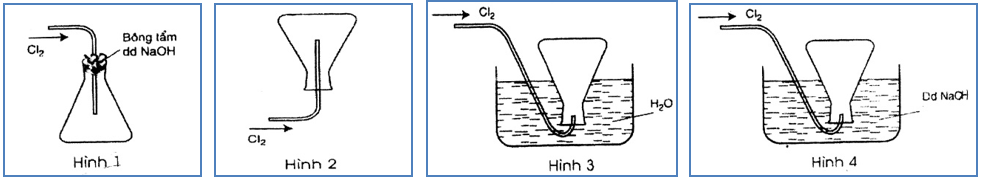
Đáp án: Hình 1.
Giải thích
- vày khí Cl2 nặng rộng không khí nên fan ta để ngửa bình (Cl2 nặng rộng không khí sẽ nằm ở dưới nó đẩy không khí bao gồm chứa sẵn trong bình ra khỏi bình và chiếm chỗ).
- cần sử dụng bông gồm tẩm hỗn hợp Na
OH làm cho không khí đi ra bên ngoài và khi bình đầy khí Cl2 thì Cl2 sẽ ảnh hưởng giữ lại vào bình ko thoát ra bên ngoài được do một phần nó pứ cùng với Na
OH với phần này bị mất đi gọi là hao chi phí trong quá trình điều chế. - ko sử dụng cách thức đẩy nước vị Cl rã trong nước.
Bài 11: trong số hình vẽ sau, hình mẫu vẽ nào mô tả đúng nhất cách thu khí HCl trong chống thí nghiệm?
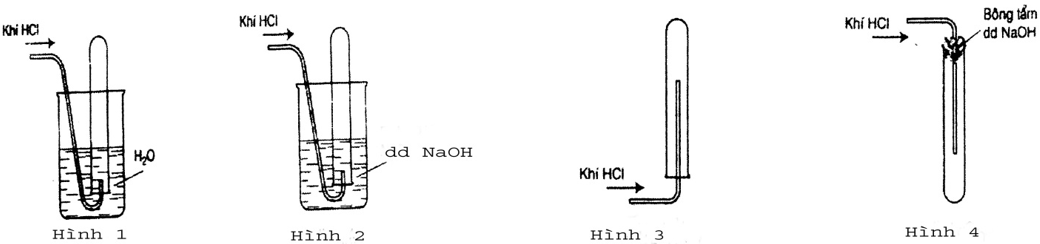
Đáp án Hình 4 (HD: vì chưng HCl nặng rộng không khí cần để ngửa ống nghiệm. HCl tan các trong nước đề nghị không sử dụng cách thức đẩy nước.)
Bài 12: Hãy giải thích: do sao người ta hoàn toàn có thể điều chế hiđro clorua (HCl), hiđro florua (HF) bằng cách cho H2 SO4 đặc công dụng với muối bột clorua hoặc florua. Nhưng quan yếu áp dụng phương pháp này nhằm điều chế hiđro bromua (HBr), hoặc hiđro iotua (HI) ?
Hướng dẫn:
Có thể pha trộn HCl và HF bằng phản ứng :
2Na
Cl + H2 SO4 → Na2 SO4 + HCl
Ca
F2 + H2 SO4 → Ca
SO4 + 2HF
Nhưng không áp dụng cách thức trên pha chế HBr và HI vì HBr và HI gồm tính khử mạnh có thể phản ứng ngay với H2 SO4 :
2HBr + H2 SO4 → Br2 + SO2 + 2H2 O
8HI + H2 SO4 → 4 I2 + H2 S + 4H2 O
Bài 13: bởi vì sao tín đồ ta rất có thể điều chế những halogen: Cl2 , Br2 , I2 bằng phương pháp cho các thành phần hỗn hợp H2 SO4 đặc với Mn
O2 chức năng với muối hạt clorua, bromua, iotua nhưng phương thức này không thể vận dụng điều chế F2 ? bằng phương pháp nào có thể điều chế được flo (F2 ) ? Viết phương trình bội nghịch ứng điều chế Flo.
Hướng dẫn:
bởi vì F gồm tính thoái hóa rất khỏe mạnh nên phương thức duy nhất nhằm diều chế F là dùng dòng điện nhằm oxi hóa ion F-trong florua nóng chảy (PP điện phân).
PTHH Điện phân hỗn hợp KF cùng HF:
2HF → H2 + F2
(KF)
Bài 14: từ Na
Cl, Mn
O2 , H2 SO4 đặc, Zn, H2 O. Hãy viết phương trình hóa học để điều chế khí hiđroclorua cùng khí Clo bằng 2 giải pháp khác nhau?
Hướng dẫn:
Mn
O2 + 4HCl
Cl2 + Cl2 ↑ + 2H2 O
2Na
Cl + 2H2 O
OH + Cl2 ↑
2Na
Cltt + H2 SO4
H2 + Cl2 → 2HCl
B. Bài bác tập trắc nghiệm
Câu 1: vào tự nhiên, các halogen
A. Chỉ tồn tại nghỉ ngơi dạng 1-1 chất.
B. Chỉ tồn tại ngơi nghỉ dạng muối hạt halogenua.
C. Chỉ tồn tại làm việc dạng vừa lòng chất.
D. Tồn tại nghỉ ngơi cả dạng 1-1 chất với hợp chất.
Lời giải:
Đáp án: C
Câu 2: Cho 4 solo chất F2 ; Cl2 ; Br2 ; I2. Chất có ánh sáng sôi cao nhất là :
A. F2.B. Cl2.C. Br2.D. I2.
Lời giải:
Đáp án: D
Câu 3: Halogen ngơi nghỉ thể rắn (điều khiếu nại thường), có tính hạnh phúc là :
A. Flo. B. Clo. C. Brom. D. Iot.
Lời giải:
Đáp án: D
Câu 4: Hãy đã cho thấy mệnh đề không đúng đắn :
A. Toàn bộ muối Ag
X (X là halogen) phần lớn không tung trong nước.
B. Toàn bộ các hiđro halogenua hầu như tồn tại làm việc thể khí, ở đk thường.
C. Tất cả các hiđro halogenua khi tan vào nước đầy đủ cho dung dịch axit.
D. Các halogen (từ F2 mang lại I2) tác dụng trực tiếp với hầu như các kim loại.
Lời giải:
Đáp án: A
Câu 5: Dãy nào được xếp đúng thứ tự tính axit cùng tính khử sút dần ?
A. HCl, HBr, HI, HF. B. HI, HBr, HCl, HF.
C. HCl, HI, HBr, HF. D. HF, HCl, HBr, HI.
Lời giải:
Đáp án: B
Câu 6: Sục Cl2 vào nước, chiếm được nước clo màu vàng nhạt. Trong nước clo tất cả chứa những chất là :
A. Cl2, H2O. B. HCl, HCl
O.
C. HCl, HCl
O, H2O.D. Cl2, HCl, HCl
O, H2O.
Lời giải:
Đáp án: D
Câu 7: vào PTN, Cl2 thường được pha trộn theo phản bội ứng :
HCl sệt + KMn
O4 → KCl + Mn
Cl2 + Cl2 + H2O
Hệ số cân đối của HCl là :
A. 4.B. 8.C. 10.D. 16.
Lời giải:
Đáp án: D
16HCl quánh + 2KMn
O4 → 2KCl + 2Mn
Cl2 + 5Cl2 + 8H2O
Câu 8: Trong chống thí nghiệm tín đồ ta thường điều chế clo bởi cách
A. Năng lượng điện phân rét chảy Na
Cl.
B. điện phân hỗn hợp Na
Cl tất cả màng ngăn.
C. Phân huỷ khí HCl.
D. Mang lại HCl đặc tính năng với Mn
O2 ; KMn
O4…
Lời giải:
Đáp án: D
16HCl đặc + 2KMn
O4 → 2KCl + 2Mn
Cl2 + 5Cl2 + 8H2O
4HCl + Mn
O2 → Cl2 + Mn
Cl2 + 2H2O
Câu 9: cho những phản ứng sau :
(a) 4HCl + Pb
O2 → Pb
Cl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(d) 2HCl + Zn → Zn
Cl2 + H2
Số phản nghịch ứng trong số đó HCl biểu lộ tính khử là :
A. 2. B. 4. C. 1.D. 3.
Lời giải:
Đáp án: A
những phản ứng trong các số ấy HCl biểu thị tính khử là : a, c
Câu 10: hàng nào được xếp đúng trang bị tự tính axit giảm dần cùng tính oxi hoá tăng mạnh ?
A. HCl
O, HCl
O3, HCl
O2, HCl
O4. B. HCl
O4, HCl
O3, HCl
O2, HCl
O.
C. HCl
O, HCl
O2, HCl
O3, HCl
O4. D. HCl
O4, HCl
O2, HCl
O3, HCl
O.
Lời giải:
Đáp án: B
Câu 11: Clorua vôi, nước Gia-ven (Javel) và nước clo miêu tả tính oxi hóa là vì
A. Chứa ion Cl
O-, nơi bắt đầu của axit gồm tính thoái hóa mạnh.
B. Cất ion Cl-, cội của axit clohiđric năng lượng điện li mạnh.
C. đầy đủ là thành phầm của chất oxi hóa mạnh dạn Cl2 cùng với kiềm.
D. Trong phân tử hầu như chứa cation của kim loại mạnh.
Lời giải:
Đáp án: A
Câu 12: cách thức duy nhất nhằm điều chế Flo là :
A. Mang lại dung dịch HF chức năng với Mn
O2.
B. Điện phân nóng chảy tất cả hổn hợp Na
F và Na
Cl.
C. Điện phân rét chảy hỗn hợp KF cùng HF.
D. đến Cl2 tác dụng với Na
F.
Lời giải:
Đáp án: C
Bài tập nhấn biết, tách bóc chất team Halogen
A. Phương pháp & Ví dụ
Lý thuyết và phương thức giải
Dựa vào các đặc điểm đặc trưng của chúng
a/ dấn biết một trong những anion ( ion âm)
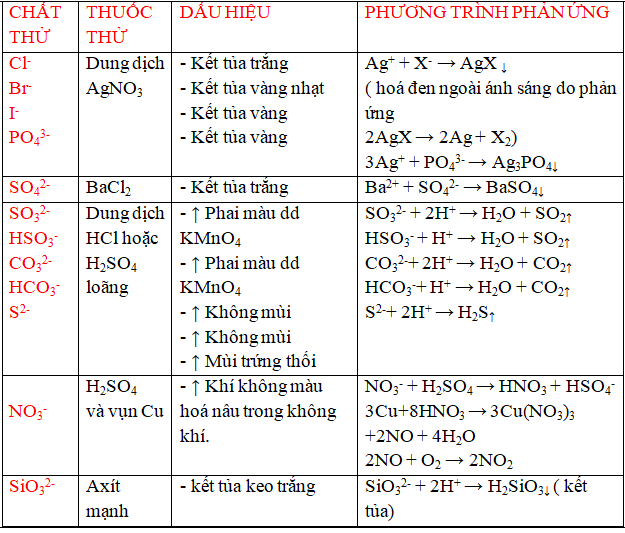
b/ dìm biết một vài chất khí .
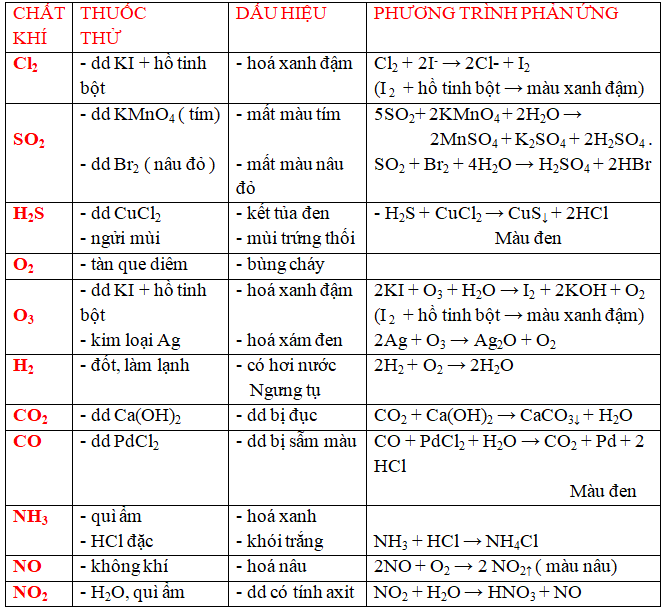
c/ dìm biết một vài chất khí .
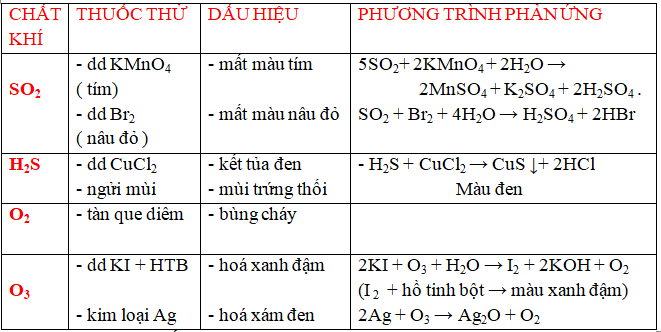
*Với bài xích tập bóc tách chất
a) tách một chất thoát khỏi hỗn phù hợp :
Dạng toán này chỉ cần tách bóc riêng một chất ra khỏi hỗn hợp, vứt bỏ các chất khác, ta có 1 trong các hai biện pháp giai sau :
- cách 1: cần sử dụng hóa hóa học phản ứng chức năng lên những chất bắt buộc loại bỏ, còn chất cần bóc riêng không chức năng sau bội nghịch ứng được bóc ra dễ dàng dàng.
- bí quyết 2: cần sử dụng hóa chất công dụng với chất bắt buộc muốn bóc riêng tạo nên phẩm mới. Sản phẩm dễ bóc tách khỏi hỗn hợp và dễ tái chế tác lại chất đầu.
b) tách bóc riêng những chất thoát khỏi nhau :
Dạng toán này bóc riêng những chất thoát ra khỏi nhau không được quăng quật chất nào. Để giải ta thực hiện đồng thời cách 1, cách 2 ngơi nghỉ trên nhằm giải.
Ví dụ minh họa
Ví dụ 1. Chỉ dùng một hóa chất, trình bày cách thức nhận biết các dung dịch sau: KI, Zn(NO3 ) 2 , Na2 CO3 , Ag
NO3 , Ba
Cl2
Hướng dẫn:
Trích mỗi hỗn hợp một ít làm mẫu thử:
Cho hỗn hợp HCl theo lần lượt vào những mẫu thử trên.
- mẫu thử tạo hiện tượng sùi bọt bong bóng khí là Na2CO3
2HCl + Na2 CO3 → 2Na
Cl + CO2 + H2 O
- mẫu mã thử tọa kết tủa trắng là Ag
NO3
Ag
NO3 + HCl → Ag
Cl↓+ HNO3
Cho dung dịch Ag
NO3 theo thứ tự vào hai mẫu thử còn lại
- chủng loại thử như thế nào kết tủa trắng là hỗn hợp Ba
Cl2
2Ag
NO3 + Ba
Cl2 → 2Ag
Cl↓ + Ba(NO3 ) 2
- chủng loại thử tạo nên kết tủa đá quý là dung dịch KI
Ag
NO2 + KI → Ag
I ↓ (vàng) + KNO3
- chủng loại thử không có hiện tượng gì là hỗn hợp Zn(NO3 ) 2
Ví dụ 2. Bằng phương pháp hóa học, hãy phân biệt những ung dịch đựng trong những lọ mất nhãn như sau: Na
F, Na
Cl, Na
Br, với Na
I.
Hướng dẫn:
Trích mỗi dung dịch một không nhiều làm mẫu mã thử:
Cho hỗn hợp Ag
NO3 thứu tự vào những mẫu test trên.Mẫu thử làm sao trong xuyên suốt là Na
F. Bởi Ag
F rã tốt.
- mẫu mã thử chế tác kết tủa trắng là Na
Cl
Ag
NO3 + Na
Cl → Ag
Cl↓ + Na
NO3
- chủng loại thử chế tác kết tủa xoàn nhạt là Na
Br
Ag
NO3 + Na
Br → Ag
Br↓ + Na
NO3
- mẫu mã thử tọa kết tủa quà đậm là Na
I
Ag
NO3 + Na
I → Ag
I↓ + Na
NO3
Ví dụ 3: . Bằng phương thức hóa học. Hãy nhận thấy các dung dịch đựng trong những lọ mất nhãn: Na
Cl, Na
Br, Na
I, HCl, H2 SO4 , KOH
Hướng dẫn:
Trích mỗi dung dịch một ít làm mẫu thử:
Cho quỳ tím thứu tự vào các mẫu thử. Ta chia thành 3 nhóm hóa chất sau:
Nhóm I: Dung dịch có tác dụng quỳ tím hóa xanh: KOH
Nhóm II: Dung dịch làm cho quỳ tím hóa đỏ: HCl, H2 SO4 .
Nhóm III: hỗn hợp không đổi màu quỳ tím: Na
I, Na
Cl, Na
Br
Cho dung dịch Ag
NO3 lần lượt vào những mẫu thử ở nhóm (III)
- mẫu mã thử tạo ra kết tủa trắng là Na
Cl
Ag
NO3 + Na
Cl → Ag
Cl↓ + Na
NO3
- mẫu thử sản xuất kết tủa kim cương nhạt là Na
Br
Ag
NO3 + Na
Br → Ag
Br↓+ Na
NO3
- chủng loại thử tọa kết tủa kim cương đậm là Na
I
Ag
NO3 + Na
I → Ag
I↓+ Na
NO3
Cho dung dịch Ag
NO3 theo thứ tự vào những mẫu thử ở nhóm (II)
- mẫu thử làm sao kết tủa trắng là HCl
Ag
NO3 + HCl → Ag
Cl↓ + HNO3
- còn lại là H2 SO4
Ví dụ 4: Không dùng thuốc thử như thế nào khác, hãy phân biệt các dung dịch: Mg
Cl2 , Na
OH, NH4 Cl, Ba
Cl2 , H2 SO4
Hướng dẫn:
Ghi số vật dụng tự 1, 2, 3, 4, 5, bên trên 5 lọ dung dịch đề nghị nhận biết. Rót dung dịch ở mỗi lọ vào lần lượt những ống nghiệm đã được đánh cùng số. Nhỏ tuổi 1 dung dịch vào mẫu thử của 4 hỗn hợp còn lại. Sau những lần thí nghiệm cho tới khi hoàn tất ta được hiệu quả sau đây:
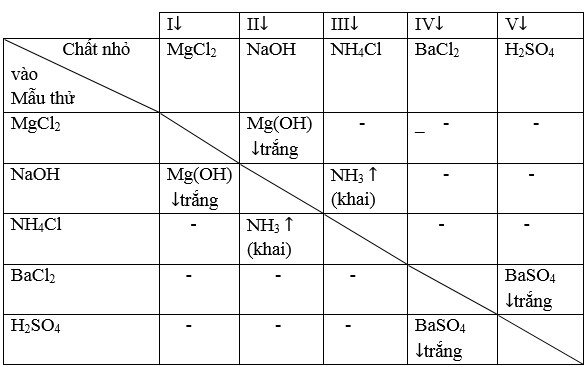
Từ bảng hiệu quả nhận thấy:
- hóa học nào chức năng với 4 chất kia tạo thành 1↓ + 1↑ là Na
OH
- chất nào chế tác thành khí với Na
OH là NH4 Cl; chất tọa thành kết tủa với Na
OH với Mg
Cl2
- Chất tác dụng với 4 hóa học khí tạo nên thành 1↓ mà khác Mg
Cl2 là Ba
Cl2 và chất tạo thành kết tủa cùng với Ba
Cl2 là H2 SO4
Ví dụ 5. Brom có lẫn một ít tạp hóa học là clo. Làm cố kỉnh nào nhằm thu được brom tinh khiết . Viết phương trình hóa học.
Hướng dẫn:
Cho một không nhiều Na
Br vào lếu láo hợp:
Cl2 + 2Na
Br → 2Na
Cl + Br2
Chưng chứa hỗn hợp để lấy Br
Ví dụ 6. tinh luyện N2 trong các thành phần hỗn hợp khí N2 , CO2 , H2 S
Hướng dẫn:
Cho hỗn hợp khí sục qua hỗn hợp nước vôi trong tất cả dư, chỉ tất cả khí N2 không chức năng đi thoát ra khỏi dung dịch, nhị khí còn sót lại phản ứng với nước vôi theo phương trình làm phản ứng:
CO2 + Ca(OH)2 → Ca
CO3 ↓ + H2 O
H2 S + Ca(OH) 2 → Ca
S ↓ + 2H2 O
B. Bài bác tập trắc nghiệm
Câu 1. bao gồm 4 chất bột white color là vôi bột, bột gạo, bột thạch cao (Ca
SO4.2H2O) bột đá vôi (Ca
CO3). Chỉ dùng chất nào dưới đấy là nhận biết tức thì được bột gạo ?
A. Dung dịch HCl. B. Hỗn hợp H2SO4 loãng.
C. Dung dịch Br2. D. Hỗn hợp I2.
Lời giải:
Đáp án: D
Cho Iot và dung dịch hồ tinh bột &r
Arr; dung dịch không màu gửi thành màu sắc xanh
Câu 2. Để rõ ràng 4 hỗn hợp KCl, HCl, KNO3, HNO3 ta có thể dùng
A. Dung dịch Ag
NO3. B. Quỳ tím.
C. Quỳ tím với dung dịch Ag
NO3.D. Đá vôi.
Lời giải:
Đáp án: C
- sử dụng quỳ tím phân biệt được 2 nhóm: HCl, HNO3 (nhóm 1) làm cho quỳ đưa đỏ và KCl, KNO3 (nhóm 2) không làm cho quỳ đưa màu.
- mang lại dung dịch Ag
NO3 lần lượt vào 2 ống nghiệm của mỗi nhóm &r
Arr; tạo kết tủa white là HCl (nhóm 1) và KCl (nhóm 2)
Ag
NO3 + HCl → Ag
Cl + HNO3
Ag
NO3 + KCl → Ag
Cl + KNO3
Câu 3.
Xem thêm: Girl Xinh 9X Dễ Thương Đáng Yêu, Hot Girl Dễ Thương 9X Đà Nẵng
rất có thể phân biệt 3 bình khí HCl, Cl2, H2 bởi thuốc test
A. Hỗn hợp Ag
NO3. B. Quỳ tím ẩm.
C. Hỗn hợp phenolphtalein. D. Không sáng tỏ được.
Lời giải:
Đáp án: B
HCl làm cho quỳ tím đưa đỏ
Cl2 làm mất màu quỳ tím
H2 không làm quỳ tím chuyển màu
Câu 4. Chỉ sử dụng hóa hóa học nào tiếp sau đây